BACTERIEMIA POR STAPHYLOCOCCUS AUREUS METICILINORRESISTENTE:
10 AÑOS DE EXPERIENCIA DE UN HOSPITAL PÚBLICO ARGENTINO
METHICILLIN-RESISTANT
STAPHYLOCOCCUS AUREUS BACTEREMIA: 10 YEARS’ EXPERIENCE IN AN ARGENTINIAN PUBLIC
HOSPITAL
Melina
Beloso ![]() 0009-0000-2632-2735,1
María José Sadonio
0009-0000-2632-2735,1
María José Sadonio ![]() 0000-0003-1256-4754,2
Julia Montiel
0000-0003-1256-4754,2
Julia Montiel ![]() 0009-0007-9141-8355,3
Jacqueline Hohnstein
0009-0007-9141-8355,3
Jacqueline Hohnstein ![]() 0009-0006-1759-3748,4
Maximiliano Gabriel Castro
0009-0006-1759-3748,4
Maximiliano Gabriel Castro ![]() 0000-0003-0112-84555
0000-0003-0112-84555
1 Médica residente de
clínica médica. Servicio de clínica médica, Hospital Dr. J. B. Iturraspe, Santa
Fe, Argentina.
2 Médica
especialista en clínica médica. Jefa de residentes de clínica médica. Servicio
de clínica médica, Hospital Dr. J. B. Iturraspe, Santa Fe.
3 Médica
especialista en clínica médica. Servicio de clínica médica, Hospital Dr. J. B.
Iturraspe, Santa Fe.
4 Médica
concurrente de clínica médica. Servicio de clínica médica, Hospital Dr. J. B.
Iturraspe, Santa Fe.
5 Médico especialista en clínica médica. Instructor de residentes de
clínica médica. Servicio de clínica médica, Hospital Dr. J. B. Iturraspe, Santa
Fe.
AUTOR
PARA CORRESPONDENCIA
Maximiliano Gabriel Castro. Correo electrónico:
mgabrielcastro@outlook.com
Los autores
manifiestan no poseer conflictos de intereses.
Descargo de responsabilidades: Melina Beloso, María
José Sadonio y Julia Montiel participaron de la concepción y diseño del trabajo,
recolección de datos, análisis e interpretación de los datos y resultados y
redacción del manuscrito. Jacqueline Hohnstein participó de la recolección de
datos y colaboró con la redacción del manuscrito. Maximiliano Gabriel Castro
participó de la concepción y diseño del trabajo, análisis e interpretación de
los datos y resultados, análisis estadístico, redacción del manuscrito y
revisión crítica del manuscrito. Todos los autores aprobaron la versión
final del manuscrito.
Resumen
Introducción. Las bacteriemias por Staphylococcus
aureus meticilinorresistente (SAMR) representan una faceta de la
multirresistencia antibiótica y, por ende, un problema para la salud pública.
Si bien se estima que la prevalencia de cepas resistentes en Latinoamérica es
del 34,9%, en nuestro país no contamos con estadísticas oficiales. Aún más,
Latinoamérica y el Caribe se encuentran subrepresentados en la literatura
disponible, lo que reduce la aplicabilidad de las recomendaciones
internacionales. Objetivo. Describir la casuística de bacteriemias por
SAMR en un efector público argentino y, de manera secundaria, comparar las
características clínicas/bioquímicas de los pacientes que presentaron mala
evolución clínica (MEC). Material y métodos. Se realizó un estudio
transversal, de inclusión ambispectiva que incluyó adultos hospitalizados por
bacteriemia documentada por SAMR en un hospital de tercer nivel de atención de
la ciudad de Santa Fe, Argentina, durante el período comprendido entre 2011 y
2022. Se excluyeron los pacientes con infección por VIH en estadio de sida y
neutropenia febril posquimioterapia. Resultados. Se incluyeron 100
bacteriemias por SAMR. Edad media 41,95 ± 16,39 años; 65% del sexo masculino.
El 67% presentaba comorbilidades; diabetes y enfermedad renal crónica (ERC)
fueron las más frecuentes. El 54,5% presentó factores de riesgo para infección
por SAMR. El 35% presentó infecciones de piel y partes blandas como causa probable
de la bacteriemia. El 49% de los pacientes presentó siembra hematógena a
distancia; el sitio más frecuente fue el pleuropulmonar (38%). Sólo hubo 4
casos de SAMR de fenotipo hospitalario. En el 18,9% (n = 17) el
antibiograma mostró resistencia al antibiótico empírico elegido. Se realizaron
hemocultivos de control en el 47%, con una positividad del 39%, lo cual se
asoció a MEC (p = 0,011) y mayor estadía hospitalaria (19 días [RIC: 25]
vs. 14 días [RIC: 14], p = 0,022). En el 34% de los pacientes, se
documentó sepsis al ingreso hospitalario, lo cual se asoció con mayor
requerimiento de terapia intensiva (70,3% [n = 19] vs. 34,6% [n
= 17], p = 0,003), a MEC (64% [n = 16] vs. 36% [n =
9], p <0,001) y a mortalidad hospitalaria (48,1% [n = 13] vs.
4% [n = 2], p <0,001). El 15% presentó mortalidad
intrahospitalaria, y el 27%, MEC. Conclusión. Se encontró una moderada
adherencia a las guías de práctica clínica, pero la mortalidad hallada fue
menor a la reportada en la literatura. La presencia de sepsis al inicio del
cuadro clínico y de bacteriemia persistente fueron los factores asociados a
mayor requerimiento de ARM y mortalidad.
Palabras clave. Staphylococcus aureus
meticilinorresistente, bacteriemia, sepsis.
Abstract
Introduction.
Methicillin-resistant Staphylococcus aureus (MRSA) bacteremia is a facet of
multidrug resistance, and therefore, a current public healthcare issue. Even
when methicillin-resistance in Latinamerica is estimated at 34,9% in
Staphylococcus aureus, there are no official reports in Argentina. Moreover,
Latinamerica and the Caribbean are underrepresented in available literature,
reducing applicability of international recommendations. Objective. To
describe the casuistry of MRSA bacteremia in an Argentinian public hospital,
and secondarily, to compare the clinical/biochemical characteristics of
patients that present with poor outcomes (PO). Material and methods. A
cross-sectional study with ambispective inclusion was conducted. It included
adults hospitalized for MRSA bacteremia in a tertiary-care center in Santa Fe,
Argentina, between 2011 and 2022. Patients with HIV and AIDS, as well as
febrile neutropenia episodes were excluded. Results. 100 MRSA bacteremia
cases were included. Mean age 41,95 ± 16,39 years. 65% men. 67% presented with
comorbidities, diabetes and chronic kidney disease being the most common. 54.5%
presented risk factors for infection due to MRSA. 35% showed skin and soft
tissue infections as a likely cause for the bacteremia. 49% of patients presented
hematogenous dissemination, the pleuropulmonary area being the most common one
(38%). There were only 4 cases of hospital-acquired MRSA phenotype. In 18.9% (n
= 17), the antibiogram showed resistance to the empirical antibiotic of choice.
Control blood cultures were carried out in 47%, with a positivity of 39%, a
fact that was associated with PO (p = 0,011) and longer hospital stay [19 days
(IQR 25) vs. 14 days (IQR 14), p = 0.022]. In 34% of patients, sepsis was
documented at admission to the facility, which was associated with a higher
requirement of intensive care unit [70.3% (n = 19) vs. 34.6% (n = 17), p =
0,003], with PO [64% (n = 16) vs. 36% (n = 9), p <0,001] and with hospital
mortality [48.1% (n = 13) vs. 4% (n = 2), p <0.001]. 15% presented intrahospital
mortality and 27% presented PO. Conclusion. A moderate adherence to
clinical practice guidelines was found, but the observed mortality was lower
than what the reviewed literature reported. Sepsis and persistent bacteremia at
the beginning of the clinical presentation were the key factors associated to a
higher requirement of mechanical ventilation and mortality.
Key words. Methicillin-resistant
Staphylococcus aureus, bacteremia, sepsis.
ark caicyt: http://id.caicyt.gov.ar/ark:/s26184311/xf3royl9o
Introducción
El
Staphylococcus aureus es el agente etiológico más frecuente de
bacteriemias en Latinoamérica (1). Dentro de esta especie,
la cepa meticilinorresistente (SAMR) cobró una importancia creciente a partir
de 1961 (2). Dicha cepa tiene por característica la
resistencia a antibióticos betalactámicos adquirida a través de la expresión de
la proteína de unión a penicilina 2 (PBP-2, su sigla en inglés) codificada por
el gen mecA contenido en los cassettes cromosómicos estafilocócicos (SCCmec) (3).
A
su vez, se describieron dos genotipos de resistencia antibiótica en el SAMR:
una cepa intrahospitalaria (SAMR-HG, codificada por los SCCmec I-III con
resistencia agregada a antibióticos no betalactámicos) y una cepa propia de las
infecciones adquiridas en la comunidad (SAMR-CG, codificada por los SCCmec IV y
V) (3). Actualmente, esta última se encuentra creciendo en
prevalencia a nivel mundial (4).
En
este sentido, las infecciones por SAMR son una faceta de la multirresistencia
antibiótica derivada del uso inadecuado de antimicrobianos. Estas, a su vez,
conllevan un mayor riesgo de muerte que su contraparte meticilinosensible (5).
Si
bien en nuestro país no contamos con estadísticas oficiales sobre este
microorganismo, diversos estudios estiman una prevalencia en Latinoamérica del
34,9% de cepas resistentes (6). Particularmente en Argentina, un 13% de cepas
de Staphylococcus aureus adquiridas en la comunidad son
meticilinorresistentes y un 51% de las cepas en cultivos de infecciones
intranosocomiales (6). A su vez, entre los pacientes
colonizados por SAMR, el SAMR-CG representó el 84,6% al ingreso hospitalario y
el 100% de las colonizaciones de novo (7).
A
pesar de la importancia de este microorganismo, en las recomendaciones emitidas
por las sociedades internacionales (8) la población
latinoamericana se encuentra subrepresentada debido a la menor disponibilidad
de literatura médica, en especial ensayos clínicos. Por esta razón cobran
especial relevancia los reportes observacionales, para dirigir el esfuerzo de
futuras investigaciones hacia los vacíos de conocimiento.
Por
esto, nos planteamos el objetivo de describir la casuística de bacteriemias por
SAMR en un efector público argentino así como, de manera secundaria, comparar
las características clínicas/bioquímicas de los pacientes que presentaron MEC.
Materiales y métodos
Estudio
transversal, de inclusión ambispectiva que incluyó de manera consecutiva a los
adultos hospitalizados por bacteriemia documentada a SAMR en un hospital de
tercer nivel de atención de la ciudad de Santa Fe, Argentina, durante el
período comprendido entre 2011 (cuando se registró la primera bacteriemia por
SAMR en esta institución) y mayo de 2022. Se consideraron criterios de
exclusión: pacientes con infección por VIH en estadio de sida (<200 CD4+) y
neutropenia febril posquimioterapia.
El
diagnóstico microbiológico se realizó a partir de botellas de hemocultivos con
5-10 ml de sangre periférica extraída por venopunción. Utilizando el equipo
BacT/ALERT (bioMérieux, Argentina), se identificaron las botellas con
crecimiento microbiológico, desde las cuales se extrajo sangre para la
realización de una tinción de Gram. En todos los casos en los cuales se
detectaron cocos grampositivos, se realizó como screening una prueba de
difusión con disco de cefoxitina para identificar de manera preliminar cepas
resistentes a la meticilina. Dichas muestras se sembraron en paralelo en placas
con Agar chocolate, que se incubaron durante una noche a 37 ºC en condiciones de microaerofilia. A partir del crecimiento en placa,
se realizó la identificación microbiológica y el antibiograma con el equipo
automatizado VITEK 2C (bioMérieux, Argentina).
Ante
la falta de tipificación genómica de las cepas de SAMR, se consideró a las
cepas de SAMR sólo sensibles a vancomicina como fenotípicamente hospitalarias
(SAMR-HF).
Para
el objetivo primario del estudio, se evaluaron las características clínicas y
microbiológicas de los pacientes incluidos, así como las conductas médicas
implementadas, a partir de información disponible en historias clínicas.
Se
garantizó la confidencialidad de la información obtenida con el fin de no
violar el secreto médico. La utilización de historias clínicas fue aprobada por
las autoridades hospitalarias.
Para
el objetivo secundario del estudio, se utilizó como criterio de valoración
combinado el desarrollo de MEC, considerada como requerimiento la ventilación
mecánica invasiva y la muerte.
Se
definió como factores de riesgo para SAMR, en base a la literatura, la
diabetes, el uso de drogas por vía endovenosa, la forunculosis a repetición y
estar institucionalizado o pertenecer a comunidades cerradas.
Se
definió sepsis como un aumento de 2 puntos en el Score SOFA respecto del basal.
Las
variables categóricas se resumieron como frecuencias y porcentajes. Se
exploraron las variables cuantitativas y se definió su normalidad de acuerdo
con la prueba de Kolmogorov-Smirnov. Se expresaron como media ± desvío estándar
o mediana y rango intercuartílico (RIC), según correspondiera.
Se
utilizaron los tests de χ2 o Fisher/Fisher-Freeman-Halton, según correspondiera, para el
análisis de variables categóricas. Para el análisis de las variables
cuantitativas, se utilizó el test T de Student o la U de Mann-Whitney. Se
definió como punto de corte para la significatividad estadística un valor p
<0,05.
Las
variables con un valor p <0,01 en el análisis bivariado para la
asociación con MEC se utilizaron para el análisis multivariado con regresión
logística binaria.
Se
realizaron los análisis estadísticos con el programa SPSS Statistics v27.0
(IBM).
Resultados
Se
incluyó un total de 100 casos de bacteriemias por SAMR, cuya incidencia
ascendió significativamente desde 2018 (Fig. 1).
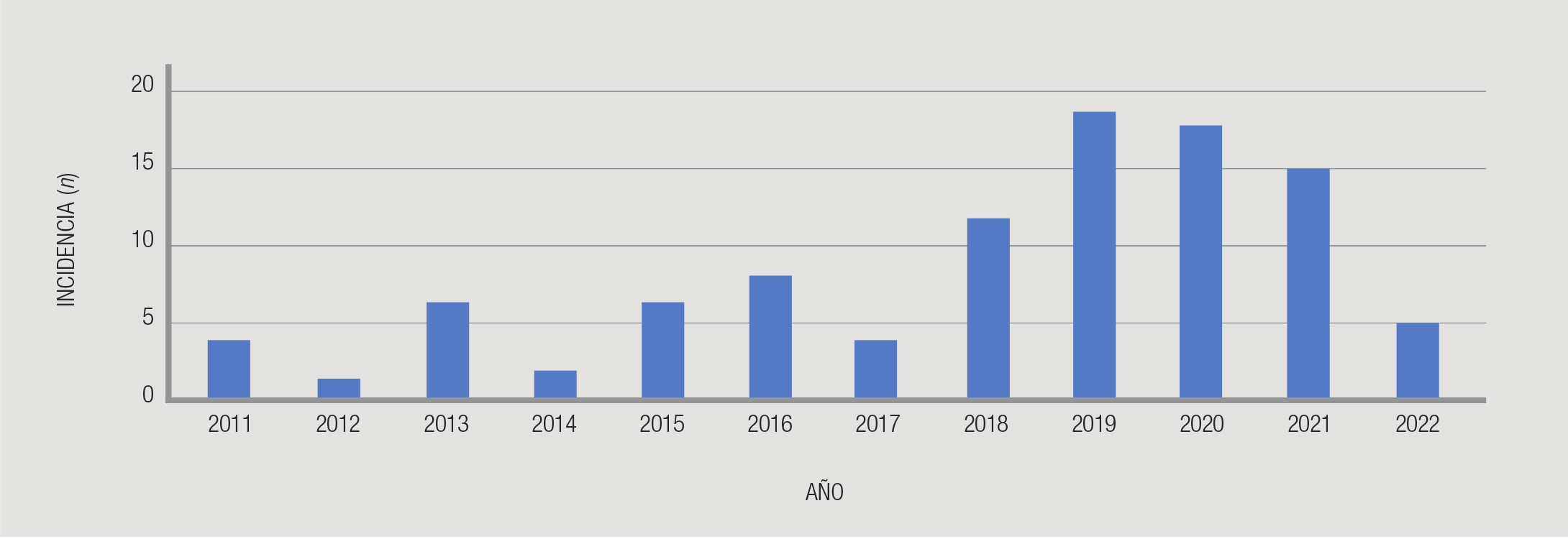
Figura 1. Incidencia de
bacteriemia por SAMR desde 2011 hasta la actualidad.
La
mayoría correspondió al sexo masculino (65%). La edad fue de 41,95 ± 16,39
años. Las principales características clínicas de manera general y comparando a
los pacientes con MEC con el resto del grupo se muestran en la tabla 1.
|
TABLA 1. CARACTERÍSTICAS
PRINCIPALES DE LA MUESTRA Y SU ASOCIACIÓN CON MALA EVOLUCIÓN CLÍNICA |
||||
|
Características |
Global |
Pacientes
con MEC n (%) |
Pacientes
sin MEC n (%) |
p |
|
Sexo masculino |
65 (65%) |
15 (55,6%) |
50 (68,5%) |
NS |
|
Edad |
41,9 |
41 +/- 16 |
42 +/- 15 |
NS |
|
Con factores de riesgo |
42 (54%) |
15 (60%) |
10 (40%) |
NS |
|
SAMR-CG |
96 (96%) |
26 (96,3%) |
70 (95,9%) |
NS |
|
SAMR-HG |
4 (4%) |
1 (3,7%) |
3 (4,1%) |
NS |
|
Origen probable de la bacteriemia |
- |
- |
- |
- |
|
IPPB |
35 (35%) |
9 (33,3%) |
26 (35,6%) |
- |
|
Acceso vascular |
16 (16%) |
7 (25,9%) |
9 (12,3%) |
- |
|
Cirugía |
13 (13%) |
2 (7,4%) |
11 (15,1) |
- |
|
Ruptura cutánea no quirúrgica |
2 (2%) |
2 (7,4) |
0 |
- |
|
Incierto |
34 (34%) |
7 (25,9%) |
27 (37%) |
- |
|
Presencia de comorbilidades |
67 (67%) |
20 (74.1%) |
47 (64,4%) |
NS |
|
Diabetes |
22 (22%) |
4 (14,8%) |
18 (24,7%) |
- |
|
Enfermedad renal crónica |
21 (21%) |
4 (14,8%) |
17 (23,3%) |
- |
|
Hemodiálisis |
19 (90% de ERC) |
4 (14,8%) |
15 (20,5%) |
- |
|
Enfermedad hematológica |
9 (9%) |
3 (11%) |
6 (8%) |
- |
|
VIH no en estadio de sida |
4 (4%) |
1 (3,7%) |
3 (4%) |
- |
|
Cirrosis |
4 (4%) |
1 (3,7%) |
3 (4%) |
- |
|
Días de internación |
14 (RIC: 17) |
20 (RIC: 26) |
14 (RIC: 14) |
NS |
|
Adquirido en la comunidad |
64 (67,4%) |
15 (55,6%) |
49 (72,1%) |
NS |
|
Bacteriemia persistente |
18 (39%) |
9 (50%) |
9 (50%) |
0,01 |
|
Presencia de siembra hematógena a
distancia |
48 (49%) |
11 (44%) |
37 (50,7%) |
NS |
|
Pleuropulmonar |
37 (37,8%) |
10 (40%) |
27 (37%) |
- |
|
Osteomioarticular |
18 (22,5) |
3 (12%) |
15 (20%) |
- |
|
Endocarditis |
3 (3,1%) |
2 (8%) |
1 (1,4%) |
- |
|
SNC |
2 (2%) |
0 |
2 (2,7%) |
- |
|
Score SOFA |
1,5 (RIC: 9) |
6 (RIC: 8) |
1 (RIC: 4) |
0,0001 |
|
Score SAPS II |
22 (RIC: 19) |
44 (RIC: 43) |
19 (RIC: 14) |
0,0001 |
|
Índice de Charlson |
2 (RIC: 9) |
2 (RIC: 4) |
2 (RIC: 3) |
NS |
|
Sepsis al ingreso |
27 (34,6%) |
16 (64%) |
11 (20,8%) |
0,0001 |
|
Antibioticoterapia empírica con
cobertura a SAMR |
75 (82,4%) |
23 (92%) |
52 (78,8%) |
NS |
El
77% de los pacientes ingresó en primera instancia a clínica médica. El resto
correspondió a UCI, cirugía general y gineco-obstetricia.
El
67% presentó comorbilidades. Entre ellos, el 25% presentó dos o más. La
diabetes y la ERC fueron las más frecuentes (22% y 21%, respectivamente); de
estos últimos, el 19% (n = 6) se encontraba en hemodiálisis. Se calculó
el score de Charlson y se obtuvo una mediana de 2 (RIC: 3) puntos.
El
54,5% (n = 42) de los pacientes presentaron factores de riesgo para
infección por SAMR.
La
mediana de tiempo de hospitalización fue de 19 (RIC: 17) días, con un mínimo de
1 día y un máximo de 85 días.
El
67% (n = 64) de las bacteriemias fueron de adquisición extrahospitalaria
y el 32,6% (n = 31) intrahospitalaria.
Considerando
el origen probable de la bacteriemia, se observó que el 35% presentaban una
infección de piel y de partes blandas como foco primario, el 16% un acceso
vascular central, el 13% un procedimiento quirúrgico, y el 2% una ruptura
cutánea no quirúrgica. Sin embargo, en el 34% no se pudo determinar el posible
origen de la infección.
La
mediana de tiempo de positivización de los hemocultivos fue de 11,7 horas.
Se
diagnosticó la presencia de siembra hematógena a distancia en el 49% de los
pacientes; la siembra a pulmón y a pleura fue la más frecuente (38%), seguida
del sistema osteomioarticular (18%). Sólo hubo 3 endocarditis y 2 infecciones
del sistema nervioso central.
Se
realizó un ecocardiograma transtorácico al 51% de los sujetos, que arrojó
hallazgos patológicos en 3 individuos; un 14% contó con ecocardiograma
transesofágico, que resultó patológico en un solo caso (1%).
Al
21% se le efectuó un examen de fondo de ojo durante la internación, y en un
paciente se identificaron hallazgos compatibles con siembra hematógena a
distancia.
Se
realizaron hemocultivos de control a las 48 horas de diagnosticada la
bacteriemia al 46%, y de ellos fueron positivos 18 (39%).
De
los pacientes con MEC, presentaron hemocultivos de control positivos el 69,2% (n
= 9), a diferencia de aquellos con buena evolución clínica, el 27,3% (n
= 9) con hemocultivo de control negativo (p = 0,011).
La
presencia de hemocultivos de control positivos se asoció a mayor tiempo de
internación [19 días (RIC: 25) vs. 14 días (RIC: 14); p = 0,022].
De
manera similar, en los pacientes con una internación mayor a 15 días, el 89%
presentó hemocultivos de control positivos, comparado con el 59% en los
pacientes con hemocultivos negativos (p = 0,03).
Sólo
se identificaron 4 casos de SAMR-HG. Excluyendo estos casos, que fueron
solamente sensibles a vancomicina dentro de los antibióticos comunes evaluados,
la resistencia a ciprofloxacina fue del 13,23%, al igual que para eritromicina,
mientras que para clindamicina fue del 11,8%, para gentamicina del 16,2%, para
levofloxacina del 7,35% y para trimetoprima-sulfametoxazol del 1,47%. No hubo
casos de resistencia a minociclina, rifampicina, tetraciclina, teicoplanina,
linezolida ni a vancomicina.
El
antibiótico empírico utilizado poseía cobertura para SAMR en el 82% (n =
75) de los eventos; no fue adecuado al compararse con antibiograma en 18,9% (n
= 17).
La
mediana del score SOFA fue de 1,5 (RIC: 9) puntos, y del score SAPS II fue de
22 (RIC: 19) puntos. Los pacientes con un score SOFA mayor a 5 puntos al
ingreso tuvieron mayor riesgo de MEC [64% (n = 16) vs. 17,7% (n
= 9); p = 0,0001]. La mediana del score SAPS II fue mayor en los
pacientes con MEC [44 (RIC: 43) vs. 19 (RIC: 14)]; p = 0,0001.
Las
principales variables de laboratorio evaluadas se muestran en la tabla 2.
|
TABLA 2.
PARÁMETROS DE LABORATORIO VALORADOS Y SU ASOCIACIÓN CON MALA EVOLUCIÓN
CLÍNICA |
||||
|
Laboratorio |
Global |
Pacientes con MEC |
Pacientes sin MEC |
p |
|
VSG
(mm/h) |
64 ± 31 |
75 ± 34 |
61 ± 30 |
NS |
|
PCR
(mg/dl) |
179 ± 138 |
356 ± 148 |
157 ± 123 |
0,01 |
|
Glóbulos
blancos |
14.000 (RIC 11.858) |
8190 (RIC 12.120) |
16.150 (11.420) |
0,01 |
|
Polimorfonucleares |
11.512 ± 7479 |
8603 ± 7481 |
12.676 ± 7229 |
0,03 |
|
Creatinina
(mg/dl) |
1,04 (RIC 1) |
1,46 (RIC 0,91) |
0,94 (RIC 0,83) |
NS |
|
Urea |
0,42 (RIC 0,71) |
0,88 (RIC 0,71) |
0,40 (RIC 0,91) |
NS |
|
LDH |
461 (RIC 350) |
397 (RIC 573) |
390 (RIC 342) |
NS |
El
34,6% (n = 27) presentaron sepsis al ingreso, lo cual se asoció con
requerimiento de terapia intensiva en [70,3% (n = 19) vs. 34,6% (n
= 17); p = 0,003], a MEC [64% (n = 16) vs. 36% (n =
9); p <0,001] y mortalidad hospitalaria de manera individual [48,1% (n
= 13) vs. 4% (n = 2); p <0,001].
El
39% estuvo internado en la unidad de cuidados intensivos; la mediana de
permanencia allí fue de 6 (RIC: 10) días. El 25,5% (n = 24) requirió
administración de drogas vasoactivas, el 30,8% (n = 24) asistencia
respiratoria mecánica (ARM) por una mediana de 5 (RIC: 13) días.
La
mortalidad intrahospitalaria fue del 15%. Se observó MEC en el 27% de los
casos.
No
se encontró asociación significativa entre el lugar de adquisición de la
bacteriemia (intrahospitalaria vs. extrahospitalaria) y la mortalidad y
requerimiento de ARM. Tampoco se encontró asociación entre la presencia de
comorbilidades, factores de riesgo para SAMR, siembra hematógena a distancia y
número de factores de riesgo con MEC. No se demostró relación entre el score de
Charlson y MEC, ni de este último con los días de internación.
En
el análisis multivariado se incluyeron la bacteriemia persistente, la sepsis al
ingreso y la presencia de siembra hematógena a distancia. Sólo los dos primeros
fueron predictores independientes de MEC. La bacteriemia aumentó las chances de
MEC 12 veces (OR: 12,4; IC del 95%: 1,22-126) y la sepsis al ingreso siete
veces (OR: 7,86; IC del 95%: 1,34-46,1).
Discusión
La
meticilinorresistencia en Staphylococcus aureus se encuentra instalada
en Latinoamérica y el Caribe y alcanza cifras alarmantes –alrededor del 50%–,
que se han mantenido estables en el tiempo (9). Las
infecciones estafilocócicas invasivas son pleomórficas en su presentación, pero
los episodios de bacteriemia tienen reservado un lugar preferencial en la
literatura médica debido a su elevada mortalidad, la cual ronda el 20-30% (10,11). Si bien al día de la fecha no se
encuentra esclarecido si las bacteriemias por SAMR conllevan un mayor riesgo
que su contraparte meticilinosensible (12), la necesidad de
escoger antibióticos con un perfil farmacocinético-farmacodinámico desfavorable
como la vancomicina dificultan su tratamiento.
La
alta tasa de endocarditis infecciosa asociada a esta patología (5-17%) y de
siembra hematógena a distancia (34%) (13) conllevan la
necesidad de identificar factores clínicos y epidemiológicos que permitan
identificar pacientes con mayor o menor riesgo de presentar estas
complicaciones y una eventual MEC, para poder desarrollar estrategias de
optimización de la terapéutica.
En
este trabajo se describió la experiencia hospitalaria a lo largo de 10 años en
un efector público argentino, de referencia para la región centro-norte de la
provincia de Santa Fe. Similar a otras publicaciones, el 67% de los individuos
presentaba comorbilidades (14). La diabetes fue la
comorbilidad más frecuente, seguida de ERC, al igual que se observó en otros
estudios (15). En cuanto a los factores de riesgo para
infección por SAMR, en esta serie el 54% presentaba al menos un factor de
riesgo. No se evaluaron otros factores de riesgo presentes en la literatura
(accesos vasculares centrales, catéteres urinarios y heridas quirúrgicas) (16,17).
El
sitio de adquisición de la bacteriemia fue más frecuente en la comunidad,
consecuente con tendencias reportadas en la literatura. Si bien esto se reporta
de forma variable, un estudio reportó un 80,4% de adquisición en la comunidad (18).
El
sitio de origen probable de la bacteriemia depende probablemente de la
naturaleza de la población estudiada. A diferencia de algunos reportes en los
que predomina el origen en infecciones asociadas a catéteres intravasculares (19) –así como sucede en personas que reciben diálisis crónica,
que tienen un alto riesgo de infecciones invasivas por SAMR (20)–
en nuestro estudio sólo el 16% estuvo asociado con estos, y el sitio de origen
más probable fueron las infecciones de piel y partes blandas (35%).
En
un estudio de casos y controles de 81 pacientes, se reportó presencia de
siembra hematógena a distancia en un 52,4% en los casos de bacteriemia por
SAMR, similar a nuestra serie, con un 49% de incidencia de este evento y una
mayor frecuencia de siembra a pulmón y a pleura (21).
La
relevancia del énfasis en la siembra hematógena a distancia radica en que, si
bien en la literatura el riesgo de endocarditis asociado a SAMR es similar a
SAMS, se ha descrito una incidencia mayor de siembra a otros sitios (22). Estos últimos, al igual que sucede en la endocarditis,
podrían justificar fallas de tratamientos cortos y evoluciones tórpidas.
Contrariamente
a lo esperado, no se encontró que la presencia de impactos sépticos o el número
de estos condicione una mayor mortalidad o requerimiento de ARM. Aún más,
tampoco estuvo relacionado con la cantidad de días de internación.
En
la literatura existe una relación tanto fisiopatológica como clínica entre la
probabilidad de diseminación a distancia y la persistencia de la bacteriemia.
Un estudio de casos y controles encontró que la bacteriemia persistente estuvo
asociada a un riesgo 20 veces mayor de siembra hematógena a distancia, con
predominio de la endocarditis infecciosa, que se presentaba con una frecuencia
10 veces mayor (23). Sin embargo, no se encontró asociación
en nuestra serie. Esto podría reflejar un efecto de sesgo de selección debido a
la moderada toma de hemocultivos de control.
A
la mitad de la población estudiada se le realizó un ecocardiograma
transtorácico, que resultó patológico en tres pacientes. Si bien la incidencia
de endocarditis infecciosa es variable (13,24-26), nuestra serie se encuentra por debajo de lo esperable. Dos
factores limitan nuestra capacidad para interpretar este hallazgo: la baja tasa
de indicación de ecocardiograma transtorácico y transesofágico y la falta de
seguimiento posterior al alta.
En
un estudio realizado con la finalidad de predecir factores de riesgo
relacionados con bacteriemias complicadas por SAMR, la persistencia de
hemocultivos de control positivos obtuvo un OR de 5,58 (IC del 95%; 3,93-7,95).
Otros factores fueron la adquisición en la comunidad, persistencia de fiebre, y
signos de infección sistémica. Los pacientes con al menos una de estas
variables estudiadas presentaron una probabilidad estimada del 35% de
bacteriemia complicada (13).
En
esta serie, si bien el SAMR-HF fue poco frecuente, la resistencia a los
antibióticos con cobertura a SAMR-CF más usados se encuentra entre el 10 y el
20%, lo cual es especialmente riesgoso en casos de infecciones severas como las
bacteriemias por SAMR, donde incluso una espera de no más de 48 horas hasta la
identificación microbiológica puede comprometer las probabilidades de
supervivencia. En este contexto, más allá de la vancomicina, la daptomicina y
la linezolida, no se observó resistencia a minociclina, tetraciclina ni
teicoplanina.
En
estos pacientes se realizaron hemocultivos de control a las 48 horas del diagnóstico
en 46 casos (47%); de ellos fueron positivos 18 (39,1%) y presentaron una
asociación estadísticamente significativa con MEC, como también con días de
hospitalización. Esto último probablemente refleja no sólo los costos en salud
derivados de esta patología sino su morbilidad. Este resultado fue comparable
con un estudio multicéntrico en el que la persistencia de bacteriemia fue un
factor de riesgo independiente para mortalidad, que aumentó un 16% por cada día
de persistencia, al mismo tiempo que prolongó la duración de la estancia
hospitalaria (27).
En
otro estudio se observó que la capacidad predictiva de los hemocultivos de
control fue mayor para predecir buena evolución: la probabilidad de
supervivencia fue del 100% a los 14 días con hemocultivos de control negativos,
pero la mortalidad ante hemocultivos positivos no excedió el 43% (28).
En
la presente serie no se evaluó el impacto de la persistencia de la bacteriemia
más allá de las 48-72 horas (primer juego de hemocultivos de reevaluación). Un
estudio multicéntrico europeo encontró que la mortalidad a los 90 días aumentó
del 22% con un día de bacteriemia al 39% con 2 a 4 días, y al 43% con 5 a 7
días (29).
Un
estudio inglés encontró una letalidad por todas las causas a los 7 días del
diagnóstico del 20%, la cual ascendía al 38% dentro de los 30 días. Otro
estudio encontró una mortalidad del 31%, la cual fue precoz en el 27,4% de los
pacientes (31). En este trabajo, se encontró una mortalidad
intrahospitalaria por debajo de lo esperable para estos reportes (15,2%). Sin
embargo, hay reportes más conservadores, con una mortalidad estimada a los 30
días del 16% (32).
En
el análisis multivariado, la bacteriemia persistente aumentó 12 veces el riesgo
de MEC, y la sepsis al ingreso, 7 veces. De manera llamativa, otras variables
asociadas en la literatura a MEC, como el score de Charlson, no se asociaron en
el análisis univariado y, por ende, no se utilizaron para construir el modelo (33). Es de remarcar que no se pudo evaluar el tiempo hasta la
positivización del hemocultivo –que se encuentra asociado a MEC y endocarditis
infecciosa (34)– debido a que sólo se contaba con este dato
en una minoría de los pacientes.
Al
día de hoy, sin embargo, no existen trabajos multicéntricos latinoamericanos
que permitan esclarecer estas asociaciones con un mayor número de pacientes y
mayor seguridad sobre los hallazgos.
Conclusiones
Existe
escasa cantidad de publicaciones latinoamericanas que atiendan a la
epidemiología de pacientes adultos con bacteriemias por SAMR. Este trabajo
expone 10 años de experiencia en esta patología en un centro de referencia de
la región centro-norte de la provincia de Santa Fe.
Existió
una sospecha clínica inicial en la mayoría de los pacientes y la terapia
empírica fue generalmente adecuada. Se encontró una moderada adherencia a las
guías de práctica clínica, pero la mortalidad hallada fue menor a la reportada
en la literatura.
El
SAMR-CG fue el fenotipo hallado en la mayoría de los casos, con bajas tasas de
resistencia frente a antimicrobianos no betalactámicos. La mayoría de los
pacientes presentaron adquisición extrahospitalaria de la bacteriemia; el
hallazgo de 4 SAMR-HF fue una excepción.
También
se encontró siembra hematógena a distancia en casi la mitad de la muestra, que,
a pesar de no relacionarse con MEC, resalta la importancia de la pesquisa de
los factores de riesgo para evitar fallas de tratamiento ante tratamientos
cortos o falta de drenaje de colecciones profundas.
La
presencia de sepsis al inicio del cuadro clínico y de bacteriemia persistente
fueron los factores asociados a mayor requerimiento de ARM y mortalidad.
Además, la persistencia de hemocultivos positivos se asoció a internaciones más
prolongadas, lo cual llevó al aumento de costos y resaltó la morbilidad
asociada a esta patología.
Agradecimientos
Al
personal de la sección de Microbiología del hospital donde se realizó el
estudio por brindarnos acceso a datos necesarios para el presente trabajo. A
los miembros del servicio de Clínica médica por el apoyo brindado.
Referencias bibliográficas
1. Diekema DJ, Pfaller MA, Schmitz FJ, et
al. Survey of infections due to Staphylococcus
species: frequency of occurrence and antimicrobial susceptibility of isolates
collected in the United States, Canada, Latin America, Europe, and the Western
Pacific Region for the SENTRY Antimicrobial Surveillance Program, 1997–1999. Clinical
Infectious Diseases 2001;32:S114-32
2. Jevons MP. “Celbenin” - resistant Staphylococci. Br Med J
1961;1:124-5
3. Lakhundi S, Zhang K. Methicillin-resistant Staphylococcus
aureus: molecular characterization, evolution, and epidemiology. Clin
Microbiol Rev 2018;31:00020-18
4. Hota B, Ellenbogen C, Hayden MK, et al. Community-associated
methicillin-resistant Staphylococcus aureus skin and soft tissue
infections at a public hospital: do public housing and incarceration amplify
transmission? Archives of Internal Medicine 2007;167:1026-33
5. Whitby M, McLaws ML, Berry G. Risk of death from
methicillin-resistant Staphylococcus aureus bacteraemia: a
meta-analysis. Medical Journal of Australia 2001;175:264-7
6. Mejía C, Zurita J, Guzmán-Blanco M. Epidemiology and surveillance
of methicillin-resistant Staphylococcus aureus in Latin America. Braz J Infect Dis 2010;14:79-86
7. Barcudi D,
Sosa EJ, Lamberghini R, et al. MRSA
dynamic circulation between the community and the hospital setting: New
insights from a cohort study. Journal of Infection 2020;80:24-37
8. Liu C, Bayer A, Cosgrove SE, et al. Clinical Practice Guidelines
by the Infectious Diseases Society of America for the treatment of
methicillin-resistant Staphylococcus aureus infections in adults and
children. Clinical Infectious Diseases 2011;52:e18-55
9. Garza-González E, Dowzicky MJ. Changes in Staphylococcus aureus
susceptibility across Latin America between 2004 and 2010. The Brazilian
Journal of Infectious Diseases 2013;17:13-9
10. Petti CA, Fowler VG. Staphylococcus aureus bacteremia and
endocarditis. Infectious Disease Clinics 2002;16:413-35
11. Røder BL, Wandall DA, Frimodt-Møller N, et al. Clinical features
of Staphylococcus aureus endocarditis: a 10-year experience in Denmark. Archives
of Internal Medicine 1999;159:462-9
12. Seas C, Garcia C, Salles MJ, et al. Staphylococcus aureus
bloodstream infections in Latin America: results of a multinational prospective
cohort study. Journal of Antimicrobial Chemotherapy 2018;73:212-22.
13. Fowler VG, Miro JM, Hoen B, et al. Staphylococcus aureus
Endocarditis: a consequence of medical progress. JAMA 2005;293:3012-21
14. Alhunaif SA, Almansour S, Almutairi R, et al.
Methicillin-resistant Staphylococcus aureus bacteremia: epidemiology,
clinical characteristics, risk factors, and outcomes in a tertiary care center
in Riyadh, Saudi Arabia. Cureus [Internet] 2021 [citado 4 de julio de
2022];13
15. Clinical predictors of methicillin-resistance and their impact on
mortality associated with Staphylococcus aureus bacteraemia. Epidemiology & Infection. Cambridge Core [Internet]. [citado 4 de julio de 2022]. Disponible
en: https://www.cambridge.org/core/journals/epidemiology-and-infection/article/clinical-predictors-of-methicillinresistance-and-their-impact-on-mortality-associated-with-staphylococcus-aureus-bacteraemia/6172B0AACAADDC9AA4C79F1D6FB51F62
16. Rezende NA, Blumberg HM, Ray SM, et al. Risk factors for
methicillin-resistance among patients with Staphylococcus aureus
bacteremia at the time of hospital admission. The American Journal of the
Medical Sciences 2002;323:117-23
17. Carnicer-Pont D, Bailey KA, Mason BW, et al. Risk factors for
hospital-acquired methicillin-resistant Staphylococcus aureus
bacteraemia: a case-control study. Epidemiology & Infection
2006;134:1167-73
18. Wyllie DH, Crook DW, Peto TE. Mortality after Staphylococcus
aureus bacteraemia in two hospitals in Oxfordshire, 1997-2003: cohort
study. The BMJ [Internet]. [citado 4 de julio de 2022]
19. Mylotte JM, McDermott C, Spooner JA. Prospective study of 114
consecutive episodes of Staphylococcus aureus bacteremia. Reviews of
Infectious Diseases 1987;9(5):891-907
20. Centers for Disease Control and Prevention (CDC). Invasive
methicillin-resistant Staphylococcus aureus infections among dialysis
patients-United States, 2005. MMWR. Morbidity and mortality weekly report, 2007
56(9):197-9
21. Ho KM, Robinson JO. Risk factors and outcomes of
methicillin-resistant Staphylococcus aureus bacteraemia in critically
ill patients: a case control study - [Internet]. 2009 [citado 5 de julio de 2022]
22. Horino T, Sato
F, Hosaka Y, et al. Predictive factors for
metastatic infection in patients with bacteremia caused by
methicillin-sensitive Staphylococcus aureus. The American Journal of
the Medical Sciences 2015;349:24-8
23. Chong YP, Park SJ, Kim HS, et al. Persistent Staphylococcus
aureus bacteremia. Medicine 2013;92:98-108
24. Chang FY, MacDonald BB, Peacock JEJ, et al. A prospective
multicenter study of Staphylococcus aureus bacteremia: incidence of
endocarditis, risk factors for mortality, and clinical impact of methicillin
resistance. Medicine 2003;82:322-32
25. Hill EE, Vanderschueren S, Verhaegen J, et al. Risk factors for
infective endocarditis and outcome of patients with Staphylococcus aureus
bacteremia. Mayo Clinic Proceedings 2007;82:1165-9
26. Fowler VG, Miro JM, Hoen B, et al. Staphylococcus aureus endocarditis:
a consequence of medical progress. JAMA 2005;293:3012-21
27. Minejima E, Mai N, Bui N, et al. Defining the breakpoint duration
of Staphylococcus aureus bacteremia predictive of poor outcomes. Clinical
Infectious Diseases 2020;70:566-73
28. Miyamoto N, Yahara K, Horita R, et al. Integration of DPC and
clinical microbiological data in Japan reveals importance of confirming a
negative follow-up blood culture in patients with MRSA bacteremia. Journal
of Infection and Chemotherapy 2017;23:687-91
29. Kuehl R, Morata L, Boeing C, et al. Defining persistent Staphylococcus
aureus bacteraemia: secondary analysis of a prospective cohort study. The
Lancet Infectious Diseases 2020;20:1409-17
30. Lamagni TL, Potz N, Powell D, et al. Mortality in patients with
meticillin-resistant Staphylococcus aureus bacteraemia, England
2004–2005. Journal of Hospital Infection 2011;77:16-20
31. Gasch O, Camoez M, Dominguez MA, et al., & REIPI/GEIH Study
Groups. Predictive factors for early mortality among patients with
methicillin-resistant Staphylococcus aureus bacteraemia. Journal of
Antimicrobial Chemotherapy. Oxford Academic [Internet]. [citado 5 de julio
de 2022]
32. Ayau P, Bardossy AC, Sanchez G, et al. Risk factors for 30-day
mortality in patients with methicillin-resistant Staphylococcus aureus
bloodstream infections. International Journal of Infectious Diseases
2017;61:3-6
33. Yilmaz M, Elaldi N, Balkan İİ, et al. Mortality predictors of Staphylococcus
aureus bacteremia: a prospective multicenter study. Ann Clin Microbiol
Antimicrob 2016;15:7
34. Siméon S, Le Moing V, Tubiana S, et al. Time to blood culture
positivity: An independent predictor of infective endocarditis and mortality in
patients with Staphylococcus aureus bacteraemia. Clin Microbiol Infect 2019;25:481-8